|
背景介绍
自2022年麻省理工学院和哈佛大学Broad科研所的Peter Tsvetkov和Todd R. Golub团队在《Science》上发布论文“Copper induces cell death by targeting lipoylated TCA cycle proteins”后,一种由铜导致的细胞死亡新形式—铜死亡逐步作为专家的科研热点。
铜 (Copper, Cu) 做为一种必需的微量营养素,在促进代谢和维持各样基本生物学功能中发挥要紧功效。人身体铜的稳态受到严格调控,铜稳态失衡会引起代谢反常并对细胞产生毒性功效。铜死亡是一种新发掘的由细胞内过量铜导致的程序性细胞死亡形式,不同于其他已知的细胞死亡途径(如细胞凋亡、坏死、焦亡和铁死亡),在癌症治疗中表示出巨大的潜能。
铜代谢过程
生物体系中的铜一般以Cu+和Cu2+两种氧化态存在,铜的生物学功能与其在氧化形式和还原形式之间循环的能力密切关联。铜重点可从器官肉类和贝类等食品中得到,成年人举荐的铜摄入量为0.8~2.4 mg/d用以维持全身铜稳态。然而,过量或不足的铜水平会引起细胞毒性和病理改变。因此呢,必要将系统铜水平保持在必定的范围内。
膳食中铜的吸收重点出现在十二指肠和小肠,肠上皮细胞对铜的吸收依赖于铜转运体1 (Cu transport protein 1, CTR1),前列腺六段跨膜上皮抗原可做为铜还原酶维持铜的还原状态,促进CTR1依赖的铜摄取。经过ATP7A介导,铜被转运进入血液,并与铜伴侣蛋白(铜蓝蛋白、血清白蛋白、组氨酸等)结合。铜经过门静脉系统被运送到肝脏(肝脏是铜稳态的中央掌控系统,亦是铜储存和铜排泄的重点器官),由金属硫蛋白1和2螯合以储存在肝细胞中。经过ATP7B介导,铜被释放到血液中,再次与可溶性伴侣蛋白结合,并被运输到特定的组织和器官。到达其靶组织后,铜催化各样生理过程中的反应,包含线粒体能量产生、酪氨酸和神经递质代谢、氧化还原稳态和细胞外基质重塑等。过量的铜经过胆汁排泄(内源性铜消除的重点形式)或做为未吸收的金属离子从粪便中排出。因此呢,身体铜的状态受肠道吸收、肝脏储存和胆汁排泄动态调节。
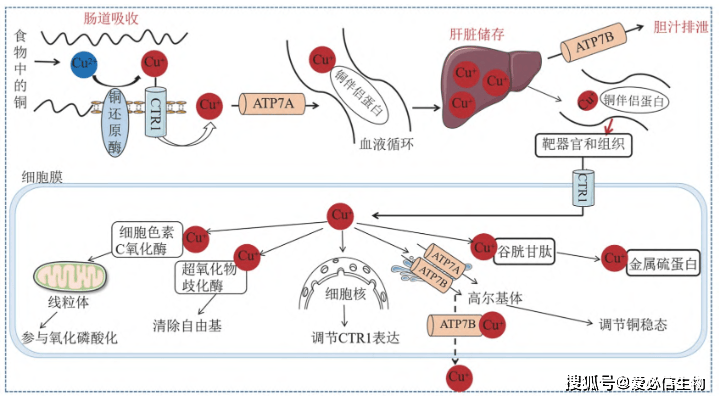 图1 正常生理状态下的铜稳态[1] 图1 正常生理状态下的铜稳态[1]
在细胞质中,经过铜伴侣蛋白协调功效,铜重点经过五种途径调控其分布并发挥生物功能:
a. 以谷胱甘肽 (glutathione, GSH) 为载体,铜被传递给金属硫蛋白;
b. 抗氧化剂1铜伴侣蛋白在反式高尔基体网络中将铜转运到ATP7A和ATP7B,调节铜稳态;
c. 铜被传递到细胞核,其中的Sp1锌指结构做为铜传感器调节CTR1的表达;
d. 超氧化物歧化酶铜伴侣蛋白将铜转运到超氧化物歧化酶1,以清除自由基;
e. 细胞色素C氧化酶铜伴侣蛋白将铜从细胞质运输到线粒体,参与氧化磷酸化和线粒体功能的维持。当铜的稳态失调时,就会出现严重的疾患,如门克斯病和威尔逊病。另外,铜缺乏亦存在于阿尔茨海默病、帕金森病、非酒精性脂肪肝、糖尿病和肥壮等疾患中。
铜水平与癌症的关系
科研显示,乳腺癌、肺癌、胃癌、甲状腺癌和前列腺癌等癌症病人肿瘤部位和血清中的铜水平显著上升[2]。铜经过结合和激活多个信号通路中的重要分子影响肿瘤出现、血管生成、肿瘤复发和转移。
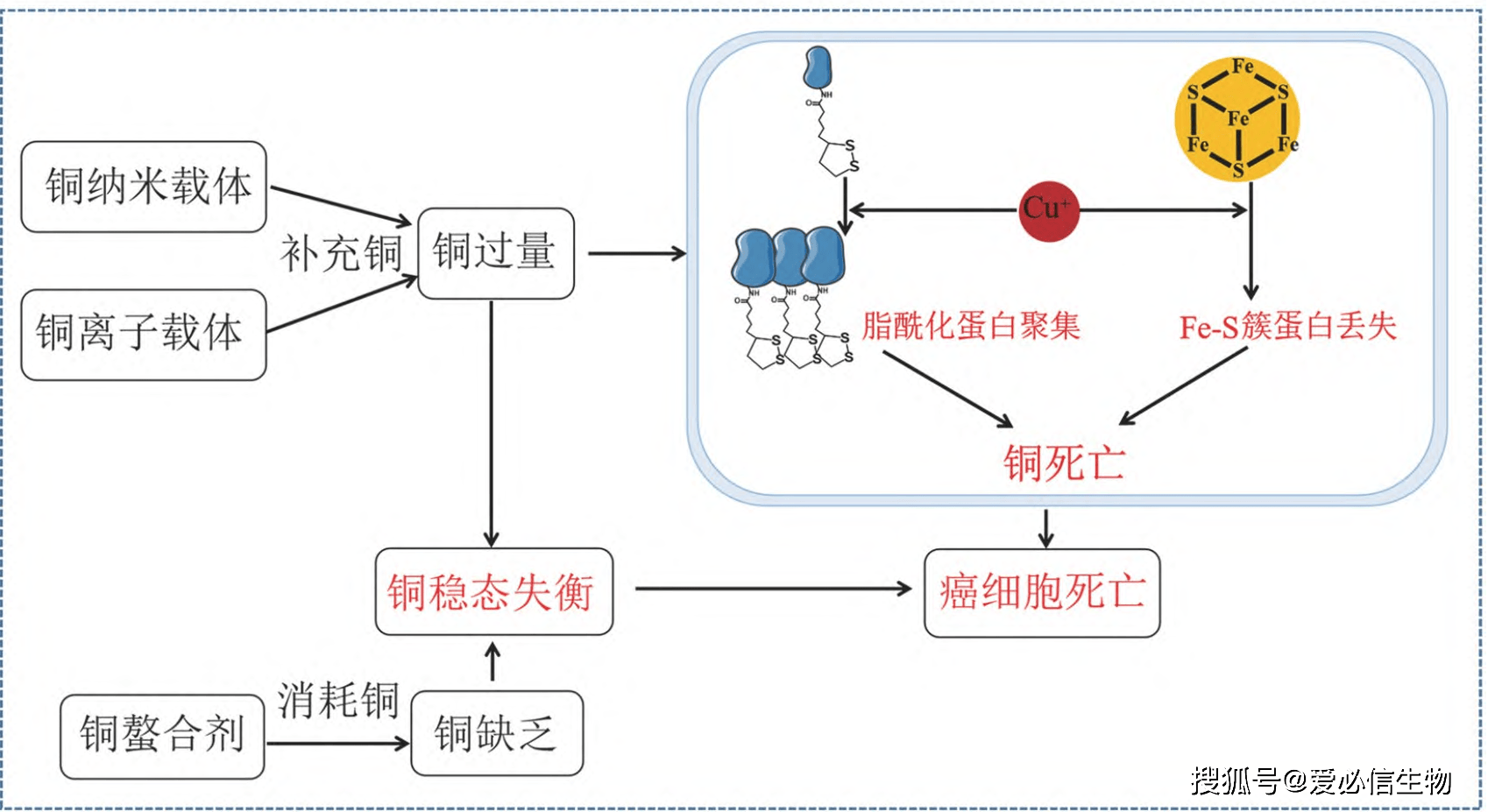 图2 铜水平与癌症的关系[1] 图2 铜水平与癌症的关系[1]
铜能够功效于受体酪氨酸激酶关联信号通路、磷酸肌醇-3-激酶信号通路和丝裂原活化蛋白激酶信号通路来促进细胞的生长和增殖。另外,铜做为一种“开关”血管生成信使,能够激活肿瘤坏死因子等血管生成因子,刺激血管内皮细胞增殖,稳定缺氧诱导因子-1,促进炎性新生血管的形成。铜还能够经过激活与转移关联的酶和信号级联,促进肿瘤细胞的侵袭和迁移。另外,铜还能够调节磷酸二酯酶3B调节肿瘤代谢。因此呢,铜能够做为抗肿瘤治疗的重要靶点。
铜离子检测在胃癌治疗中的应用
2023年10月20日,上海市第1人民医院黄陈教授和范广建教授团队在Nature Communications杂志上发布了题为“Lactylation of METTL16 promotes cuproptosis via m6A-modification on FDX1 mRNA in gastric cancer”的科研论文。科研揭示了METTL16调控胃癌细胞铜死亡的分子机制,阐明乳酰化修饰及m6A修饰在胃癌发展中的要紧道理,为胃癌的治疗供给新的靶标和策略。
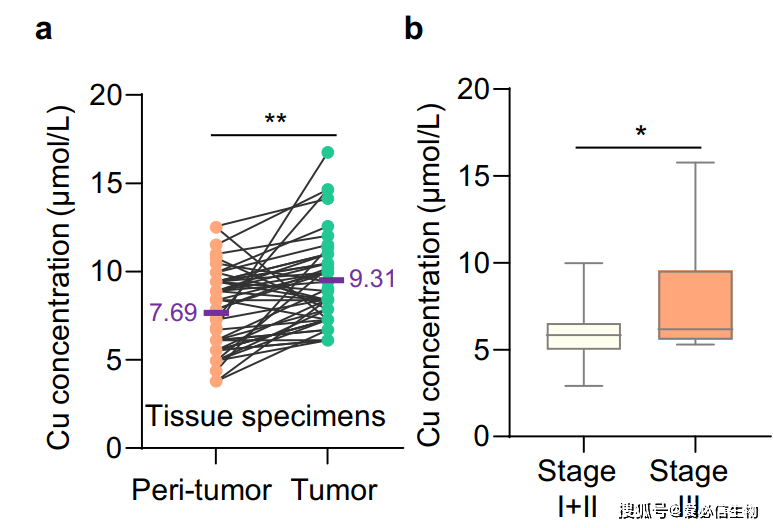 图3 胃癌组织中铜含量较高,与肿瘤发展相关[3]。 图3 胃癌组织中铜含量较高,与肿瘤发展相关[3]。
a.胃癌组织中铜的浓度(绿点)(n=48)显著高于邻近正常组织(橙点)(n=48),(紫色字体为铜浓度均值,P<0.01)。
b. III期胃癌病人的相对铜含量高于I期和II期胃癌病人(P<0.05)。
铜离子检测试剂盒操作过程
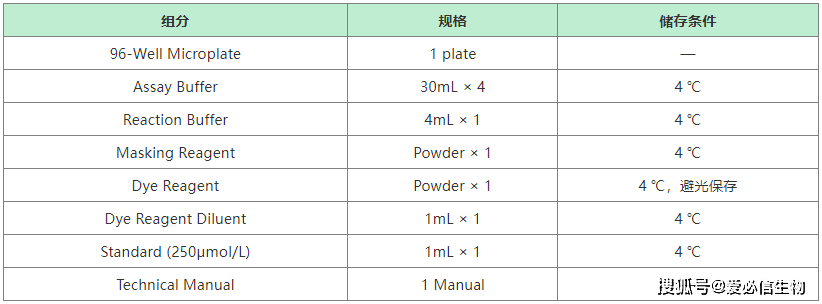
1、试剂盒组分
二、操作过程:
1、材料和试剂:
自备材料:酶标仪、蒸馏水、移液器与枪头、离心机、计时器、湿冰等。
标准品:用蒸馏水连续两倍梯度稀释标准品(现配现用)。
Masking Reagent:运用1mL蒸馏水溶解(现配现用)。
Dye Reagent:运用1mL Dye Reagent Diluent溶解Dye Reagent,70℃加热助溶(现配现用)。
2、样本处理:
a. 组织样本:叫作取1g组织,加入1mL Assay buffer在湿冰上匀浆,4℃,10000g离心10min,上清液转移至新离心管中,湿冰上保留待检测。
b. 细胞/细菌样本:将细胞/细菌(5×106)收集到离心管中,离心后去掉上清液,加入1mL Assay buffer,超声处理(功率20%,超声3s,间隔10s,重复30次)后于4℃,10000g离心10min,上清液转移至新离心管中,湿冰上保留待检测。
c. 液体样本:直接检测。
3、上样:分别将140uL不同浓度的标准品、样品加入相应孔中,另设置空白孔加入140uL蒸馏水;每孔分别再加入40uL Reaction Buffer,10uL Masking Reagent以及10uL Dye Reagent,混合均匀,室温孵育15min。
4、检测:运用酶标仪测定605nm处的吸光度,拟合标准曲线并计算样本浓度。
平常问题解答
Q1:该试剂盒检测组织样本,对组织样本的处理有需求吗?
A1:金属螯合剂(如EDTA)会干扰此分析,在样品制备中应避免运用。
Q2:该试剂盒检测的是Cu+还是Cu2+还是总铜?
A2:试剂盒检测的是总铜。
Q3:样品的稀释倍数有举荐吗?
A3:针对未知的样品,咱们意见多做几个稀释梯度进行预实验,以确定合适的稀释倍数。
Q4:试剂盒操作说明书中既有标准曲线法又有公式法,我应该选取哪种计算方式?
A4:两种方式任选一种就能够,公式是简便算法,意见根据标曲计算,会更加准确。必须重视的是,运用标准曲线法,每次实验必要重新绘制标准曲线。
Q5:试剂盒中的Dye Reagent稀释溶解后应该怎样保留?
A5:染料(Dye)现配现用,溶解后易氧化变质,意见分装后4℃,避光保留。
参考文献
[1] 史晓群, 杜希友.铜死亡机制及关联抗癌药品[J].生命的化学, 2024, 44(2): 225-232.
[2] Xie J, Yang Y, Gao Y, et al. Cuproptosis: mechanisms andlinks with cancers[J]. Mol Cancer, 2023, 22(1): 46.
[3] Sun L, Zhang Y, Yang B, et al. Lactylation of METTL16 promotes cuproptosis via m6A-modification on FDX1 mRNA in gastric cancer[J]. Nature Communications, 2023, 14(1).
 返回外链论坛:http://www.fok120.com/,查看更加多 返回外链论坛:http://www.fok120.com/,查看更加多
责任编辑:网友投稿
|